英文名称:Guideline on the Inspection and Evaluation of Physicochemical and Hygienic Indicators of Health Food (2020)
发布时间:2020/10/31
实施时间:2020/10/31
发布单位:国家市场监督管理总局
UC 保健食品理化及卫生指标检验与评价技术指导原则(2020年版)
目 录
第一部分 总则
一、主题内容和适用范围
二、基本要求
第二部分 功效成分/标志性成分检验方法
一、保健食品中红景天苷和酪醇的测定
二、保健食品中大蒜素的测定
三、保健食品中芦荟苷的测定
四、保健食品中左旋肉碱的测定
五、保健食品中α-亚麻酸、γ-亚麻酸的测定
六、保健食品中人参皂苷的测定
七、保健食品中前花青素的测定
八、保健食品中核苷酸的测定
九、保健食品中洛伐他汀的测定
十、保健食品中槲皮素、山柰素、异鼠李素的测定
十一、保健食品中茶氨酸的测定
十二、保健食品中五味子醇甲、五味子甲素和乙素的测定
十三、保健食品中腺苷的测定
十四、保健食品中总皂苷的测定
十五、保健食品中总黄酮的测定
十六、保健食品中壳聚糖脱乙酰度的测定
十七、保健食品中总蒽醌的测定
十八、保健食品中10-羟基-2-癸烯酸的测定
十九、保健食品中绞股蓝皂苷XL IX的测定
二十、保健食品中总三萜的测定
二十一、保健食品中虫草素的测定
二十二、保健食品中D-甘露醇的测定
二十三、保健食品中功效成分/标志性成分食品安全国家标准检测方法
第三部分 溶剂残留的测定
第四部分 违禁成分的测定
一、主题内容和适用范围
1.本指导原则规定了保健食品及其原料、辅料理化及卫生指标检验与评价的基本要求、功效成分/标志性成分检验方法、溶剂残留和违禁成分的测定要求。
2.本指导原则适用于保健食品的注册和备案检验。
二、基本要求
1. 保健食品应符合《食品安全国家标准 保健食品》(GB 16740)的各项要求和检验方法规定。对于不同配方、不同形态、不同工艺的产品,申请人应同时制定符合要求的理化、功效成分/标志性成分、微生物等指标对产品质量进行有效控制。
2. 直接接触保健食品的包装材料应符合相应食品安全国家标准及相关规定。
3. 普通食品形态产品应检测并制定净含量及允许负偏差指标,指标应符合《定量包装商品净含量计量检验规则》(JJF 1070)规定。胶囊等非普通食品形态产品应制定装量或重量差异指标。装量或净含量只检测内容物,不包括隔离材料。
4. 最小服用单元含有惰性隔离材料填充的产品,如胶囊,其功效成分或者指标成分、农药残留、灰分、水分等指标以去除隔离材料(胶囊壳)的内容物为检测单元,对于非法添加药物、重金属、铬、色素(如材料带颜色)等则需要进行整体检测,或者检测结果明确标识相关检测部位。
5. 本指导原则第二部分提供的检测方法为推荐方法,注册申请人在对产品进行功效成分/标志性成分检测时,应选择适合相应产品的检测方法。申请注册检验时,应提供该产品的配方、工艺、产品技术要求及功效成分/标志性成分检测方法以及检测方法的适用性、重现性等方法学研究材料。检测方法应科学、适用、重现。注册检验机构对所附材料进行审核,必要时进行有关验证和方法确认,如申报单位提供的方法不适合送检的样品时,注册检验机构不得擅自修改,应将有关情况反馈申报单位,由其进行研究并提供方法后,再对送检样品进行试验,确保试验方法与送检产品技术要求中规定的方法一致。复核检验机构应按照申报单位提交的检验方法进行检验并出具复核检验报告。
6. 注册申请人应当自行开展或委托具备法定资质的注册检验机构,按照国家相关规定和标准等要求,根据样品具体情况,合理地进行稳定性试验设计和研究。通过稳定性试验,考察样品在不同环境条件下(如温度、相对湿度等)的化学、物理及生物学特征随时间增加其变化程度和规律,从而判断样品包装、贮存条件和保质期内的稳定性。产品稳定性重点考察指标,主要包括感官、微生物、崩解时限(溶散时限、溶化性等)、水分、pH值、酸价、过氧化值、列入理化指标中的特征成分等随储存条件和储存时间容易发生变化的指标。产品非稳定性重点考察指标,主要包括鉴别、灰分、污染物(如铅、总砷、总汞等)、真菌毒素、农残(如六六六、滴滴涕等)、国家相关标准及现行规定有用量限制的合成色素和甜味剂等随储存条件和储存时间不易发生变化的指标,以及国家相关标准及现行规定有用量限制的抗氧化剂指标。
稳定性试验为注册申请人自行开展的,组织实施的检验质量控制、报告编制、样品和档案管理等工作以及出具的报告格式内容,应当符合有关规定。稳定性试验为注册申请人委托检验的,被委托单位应当为具有法定资质的食品检验机构。
7. 标准规定不得检出的项目结果,检测结果在方法定量限以上时,按照具体检出值报送结果;检测结果在方法检出限以下时,注明“未检出,检出限值”;检测结果在方法检出限以上、定量限以下时,注明“检出且小于定量限,定量限值,检出限值”。
8. 保健食品中原料和辅料应符合保健食品原辅料质量要求的有关规定,有适用的国家相关标准、地方标准、行业标准等的,其质量应符合相关规定。原辅料质量要求内容有缺项难以或无需制定的,应说明原因。原料若为植物提取物或者原料及辅料加工过程中使用、间接引入有机溶剂时,涉及的有机溶剂应符合《食品安全国家标准 食品添加剂使用标准》(GB 2760)附录C中食品工业用加工助剂使用名单规定,或有关规定。企业可根据产品质量控制需要,采用本指导原则中第三部分溶剂残留的测定方法将溶剂残留检测列入原料或产品的技术要求。
9. 违禁成分的检测作为相应保健功能类别产品的功能试验样品注册检验要求,应当符合本指导原则第四部分的规定。
第二部分
功效成分/标志性成分检验方法
一、保健食品中红景天苷和酪醇的测定
1 范围
本方法规定了以红景天为主要原料的保健食品中红景天苷和酪醇的液相色谱测定方法。
本方法适用于保健食品中红景天苷和酪醇的测定。
2 原理
试样经甲醇超声提取,以0.01mol/L乙酸铵-甲醇为流动相(80+20),采用高效液相色谱法,紫外检测器检测,根据保留时间定性,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 乙酸铵(CH3COONH4)。
3.1.2 甲醇(CH3OH):色谱纯。
3.1.3 甲醇(CH3OH)。
3.2 标准品
红景天苷、酪醇标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1 红景天苷、酪醇标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
|
中文名称 |
英文名称 |
CAS登录号 |
分子式 |
相对分子量 |
|
红景天苷 |
Salidroside |
10338-51-9 |
C14H20O7 |
300.30 |
|
酪醇 |
Tyrosol |
501-94-0 |
C8H10O2 |
138.16 |
3.3.1 红景天苷标准储备液(2.0mg/mL):准确称取红景天苷标准品20mg(精确至0.01mg)于10mL容量瓶中,用甲醇(3.1.2)溶解并定容至刻度,摇匀。
3.3.2 红景天苷标准工作液:将红景天苷标准储备液(3.3.1)用甲醇(3.1.2)稀释制备一系列标准溶液,标准系列浓度为0.00mg/mL、0.01mg/mL、0.02mg/mL、0.05mg/mL、0.20mg/mL、0.50mg/mL,临用时配制。
3.3.3 酪醇标准储备液(2.0mg/mL):准确称取酪醇标准品20mg(精确至0.01mg)于10mL容量瓶中,用甲醇(3.1.2)溶解并定容至刻度,摇匀。
3.3.4 酪醇标准工作液:将酪醇标准储备液(3.3.3)用甲醇(3.1.2)稀释制备一系列标准溶液,标准系列浓度为0.00mg/mL、0.01mg/mL、0.02mg/mL、0.05mg/mL、0.10mg/mL、0.20mg/mL,临用时配制。
3.3.5 系统适用性溶液:量取红景天苷标准储备液(3.3.1)和酪醇标准储备液(3.3.3)各0.5mL于10mL容量瓶中,用甲醇(3.1.2)稀释至刻度,摇匀。
3.4 试剂配制
乙酸铵溶液(0.01mol/L):称取0.77g乙酸铵,加入适量水溶解并定容至1000mL,经0.45μm滤膜(3.5.1)过滤后备用。
3.5 材料
3.5.1 水相微孔滤膜:0.45µm。
3.5.2 有机相微孔滤膜:0.45µm。
4 仪器和设备
4.1 高效液相色谱仪:配有紫外检测器(UV)。
4.2 超声波清洗器。
4.3 分析天平:感量为0.01mg和0.0001g。
5 分析步骤
5.1 试样制备
5.1.1 固体样品:准确称取已粉碎混合均匀的固体待测试样适量(约含红景天苷5mg)于 25mL容量瓶中,加入甲醇(3.1.3)约20mL,超声提取30min,放冷至室温,用甲醇(3.1.3)定容至刻度。混匀后经0.45μm滤膜(3.5.2)过滤,供液相色谱分析用。
5.1.2 液体样品:准确吸取摇匀后的待测试样适量(约含红景天苷5mg),置于蒸发皿内,水浴蒸干,用甲醇溶解并(3.1.3)转移至25mL容量瓶中并定容至刻度。混匀后经0.45μm滤膜(3.5.2)过滤,供液相色谱分析用。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱, 250mm×4.6mm, 5μm,或同等性能色谱柱;
5.2.2 流动相:乙酸铵溶液(0.01mol/L)-甲醇(80+20);
5.2.3 流速:1.0mL/min;
5.2.4 柱温:25℃;
5.2.5 检测波长:215nm;
5.2.6 进样量:10L。
5.2.7 系统适用性试验:取系统适用性溶液(3.3.5)10L,注入液相色谱仪,记录色谱图,红景天苷峰与酪醇峰的分离度应大于1.5。
5.3 标准曲线的制作
将红景天苷标准系列工作液(3.3.2)或酪醇标准系列工作液(3.3.4)分别注入高效液相色谱仪中,测定相应的色谱峰高或峰面积,以标准工作液的浓度为横坐标,以峰面积或峰高为纵坐标,绘制标准曲线(标准溶液液相色谱图见附录A中图A.1)。
5.4 试样溶液的测定
将试样待测液(5.1.1或5.1.2)注入液相色谱仪中,以保留时间定性,测得峰面积或峰高,根据标准曲线得到待测液红景天苷或酪醇的浓度(样品溶液液相色谱图见附录A中图A.2)。
6 结果计算
试样中红景天苷或酪醇含量按下式计算:
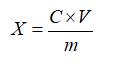
X—试样中红景天苷或酪醇的含量,单位为毫克每克或毫克每毫升(mg/g或mg/mL);
C—由标准曲线查得待测样液中红景天苷或酪醇的浓度,单位为毫克每毫升(mg/mL);
V—样品的定容体积,单位为毫升(mL);
m—样品量,单位为克或毫升(g或mL)。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留两位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。

二、保健食品中大蒜素的测定
1 范围
本方法规定了保健食品中大蒜素(二烯丙基三硫化物)的测定方法。
本方法适用于以大蒜及其加工品为主要原料制成的保健食品中大蒜素(二烯丙基三硫化物)的测定。
试样经有机溶剂提取,通过气相色谱检测,以保留时间定性,外标法定量。
注:除非另有说明,本方法所用试剂均为分析纯。
3.1 试剂
3.1.1 无水乙醇(C2H5OH)。
3.1.2 正己烷(CH3(CH2)4CH3)。
3.1.3 无水硫酸钠(Na2SO4)。
3.2 标准品
大蒜素标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥99.0%,或经国家认证并授予标准物质证书的标准物质。
表1 大蒜素标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
|
中文名称 |
英文名称 |
CAS登录号 |
分子式 |
相对分子量 |
|
大蒜素 |
Allitride |
2050-87-5 |
C6H10S3 |
178.33 |
3.3 标准溶液配制
3.3.1 大蒜素标准储备液(5.0mg/mL):称取125.0mg大蒜素于25mL容量瓶中,用正己烷(3.1.2)定容至刻度,摇匀。此溶液可在4℃冰箱中保存七天。
3.3.2 大蒜素标准工作液:分别准确吸取不同体积的标准储备液(3.3.1),用正己烷(3.1.2)将其稀释成大蒜素含量分别为0.1mg/mL、0.5mg/mL、1.0mg/mL、1.5mg/mL、2.0mg/mL的标准系列工作溶液,临用配制。
3.4 材料
微孔滤膜:0.45µm,有机相。
4.1 气相色谱仪:配有氢火焰离子化检测器(FID)。
4.2 分析天平:感量为0.01mg和0.0001g。
4.3 超声清洗器。
5.1 试样制备
5.1.1 固体试样
称取已粉碎混合均匀的固体待测试样适量(含待测组分约5mg,精确到0.0001g)于5mL容量瓶中,加无水乙醇2.5mL,密塞,超声(功率800W,频率40kHz)提取20min,取出冷却至室温,加正己烷定容,摇匀,过0.45μm微孔滤膜过滤,待上机测试用。
5.1.2 油状试样
称取已混合均匀的油状待测试样适量(含待测组分约5mg,精确到0.0001g)于5mL容量瓶中,加正己烷溶解并定容,摇匀,过0.45μm微孔滤膜过滤,待上机测试用。
5.1.3 含水液体试样
精密吸取已混合均匀的待测试样适量(含待测组分约10mg),置于分液漏斗中,加4mL正己烷振摇提取1min,静置分层,取上层清液过无水硫酸钠,提取两次。用适量正己烷冲洗无水硫酸钠,合并至同一10mL容量瓶中,用正己烷定容至刻度,摇匀。过0.45μm微孔滤膜过滤,待上机测试用。
5.2 仪器参考条件
5.2.1 色谱柱:(5%-苯基)-甲基聚硅氧烷固定相,柱长30m,内径0.25mm,膜厚0.25μm或其他同等性能色谱柱。
5.2.2 柱温箱温度:起始温度100℃保持3min,10℃/min速度升至150℃,再以20℃/min速度升至200℃,保持20min。
5.2.3 进样口温度:220℃。
5.2.4 检测器温度:250℃。
5.2.5 载气:高纯氮气,流量1.0mL/min。
5.2.6 氢气:40mL/min;空气:400mL/min。
5.2.7 进样量:1μL。
5.3 测定
将1μL的标准工作溶液(3.3.2)和试样溶液(5.1)注入气相色谱仪中,以保留时间定性,测得峰面积或峰高,外标法定量。
标准工作溶液图谱及试样溶液图谱见附录A。
试样中大蒜素含量按下式计算:

式中:
W—大蒜素的含量,单位为克每百克或克每百毫升(g/100g或g/100mL);
A1—试样溶液色谱峰面积或峰高;
A2—标准工作液峰面积或峰高;
C—标准工作液浓度,单位为毫克每毫升(mg/mL);
V—试样定容体积,单位为毫升(mL);
m—试样的质量或体积,单位为克或毫升(g或mL);
100—单位转换;
1000—单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。

三、保健食品中芦荟苷的测定
1 范围
本方法规定了保健食品中芦荟苷含量的高效液相色谱测定方法。
本方法适用于以芦荟及其加工品为主要原料的保健食品中芦荟苷含量的测定。
2 原理
样品用甲醇+水(55+45)作为溶剂,提取试样中的芦荟苷,经C18柱分离,在293nm波长处检测,以芦荟苷保留时间定性,峰面积外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 甲醇(CH3OH):色谱纯。
3.1.2 石油醚:沸程30℃~60℃。
3.2 标准品
芦荟苷标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥90%,或经国家认证并授予标准物质证书的标准物质。
表1 芦荟苷标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
|
中文名称 |
英文名称 |
CAS 登录号 |
分子式 |
相对分子量 |
|
芦荟苷 |
Aloin |
1415-73-2 |
C21H22O9 |
418.39 |
3.3 标准溶液配制
3.3.1 芦荟苷标准储备液:称取芦荟苷标准样品(3.2)10mg(精确至0.01mg)于25mL容量瓶中,加流动相溶解并定容至刻度,摇匀,此溶液浓度为0.4mg/mL。临用新配。
3.3.2 芦荟苷标准系列工作液:分别准确吸取芦荟苷标准储备液(3.3.1)0.5mL、1.0mL、2.0mL、4.0mL、6.0mL至10mL容量瓶中,用流动相定容,得浓度为0.02mg/mL、0.04mg/mL、0.08mg/mL、0.16mg/mL、0.24mg/mL的标准系列工作液。
3.4 微孔滤膜:0.45µm,有机相。
4 仪器和设备
4.1 高效液相色谱仪:配有二极管阵列检测器或紫外检测器。
4.2 超声波清洗器。
4.3 分析天平:感量分别为0.01mg和0.001g。
4.4 离心机:转速≥3000r/min。
5 分析步骤
5.1 试样制备
5.1.1 固体试样
称取已粉碎混合均匀的待测试样适量(约含芦荟苷4mg,精确到0.001g),置具塞锥形瓶中,加入50.0mL流动相(5.2.2),称重,超声处理20min,放冷,用流动相补足减失的重量,摇匀,经微孔滤膜(3.4)过滤,滤液待测。必要时可进行适当稀释。
5.1.2 含油基质试样
称取已粉碎混合均匀的待测试样适量(约含芦荟苷4mg,精确到0.001g),置具塞锥形瓶中,加入25.0mL石油醚(3.1.2),涡旋使充分混匀,过滤,弃去石油醚液,再用少量石油醚洗涤锥形瓶及滤纸,挥干,将滤纸和残渣置于原具塞锥形瓶中,加入50.0mL流动相(5.2.2),称重,超声处理20min,放冷,用流动相补足减失的重量,摇匀,经微孔滤膜(3.4)过滤,滤液待测。必要时可进行适当稀释。
5.1.3 水性液体试样
吸取待测试样,必要时以流动相(5.2.2)适当稀释,离心,取上清液经微孔滤膜(3.4)过滤。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱, 250mm×4.6mm,5μm,或性能相当者。
5.2.2 流动相:甲醇(3.1.1)+水,(55+45,v/v)。
5.2.3 流速:1.0mL/min。
5.2.4 柱温:40℃。
5.2.5 检测波长:293nm。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将标准系列工作液(3.3.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的芦荟苷标准溶液的色谱峰面积,以标准工作液的浓度为横坐标,以色谱峰的峰面积为纵坐标,绘制标准曲线。
5.4 试样溶液的测定
将试样溶液(5.1)按液相色谱参考条件(5.2)进行测定,得到相应的样品溶液芦荟苷的色谱峰面积,根据标准曲线得到待测液中芦荟苷的浓度,平行测定次数不少于两次。
芦荟苷的标准液相色谱图参见附录A的图A.1。
6 结果计算
试样中芦荟苷含量按下式计算:
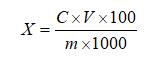
式中:
X—试样中芦荟苷的含量,单位为克每百克(g/100g)或克每百毫升(g/100mL);
C—由标准曲线得出的样液中芦荟苷的浓度,单位为毫克每毫升(mg/mL);
V—试样的最终定容体积,单位为毫升(mL);
m—试样取样量,单位为克(g)或毫升(mL);
100—单位转换;
1000—单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。

四、保健食品中左旋肉碱的测定
1 范围
本方法规定了保健食品中左旋肉碱的液相色谱测定方法。
本方法适用于以左旋肉碱为主要原料的保健食品中肉碱的含量测定。
2 原理
试样中的左旋肉碱以0.50mmol/L的盐酸溶液经超声提取,反相色谱分离,以保留时间定性,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 磷酸氢二钾(K2HPO4)。
3.1.2 辛烷磺酸钠(C8H17NaO3S)。
3.1.3 盐酸(HCl):含量:36%~38%。
3.1.4 磷酸(H3PO4)。
3.1.5 硅藻土(SiO2):粒径范围:0.2-0.8mm。
3.1.6 乙腈(CH3CN):色谱纯。
3.2 标准品
左旋肉碱标准样品的分子式、相对分子量、CAS登录号见表1,纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
表1 左旋肉碱标准样品的中文名称、英文名称、CAS登录号、分子式、相对分子量
中文名称
英文名称
CAS登录号
分子式
相对分子量
左旋肉碱
L-Carnitine
541-15-1
C7H15NO3
161.20
3.3 标准溶液配制
3.3.1 左旋肉碱标准储备液:称取25mg(准确至0.01mg)左旋肉碱标准品(3.2)于25mL容量瓶中,用盐酸溶液(3.4)溶解并定容至刻度,摇匀。此溶液浓度为1.0mg/mL。
3.3.2 左旋肉碱标准系列工作液:分别准确吸取左旋肉碱标准储备液(3.3.1)0.50mL、1.0mL、2.0mL、3.0mL、4.0mL、5.0mL于5mL容量瓶中,用盐酸溶液(3.4)稀释至刻度,得浓度分别为0.10mg/mL、0.20mg/mL、0.40mg/mL、0.60mg/mL、0.80mg/mL、1.00mg/mL的标准系列工作液。临用时配制。
3.4 盐酸溶液(0.5mmol/L):准确吸取4.2mL盐酸(3.1.3),用水定容至100mL。摇匀后,再吸取上述溶液1.0mL,用水定容至1L。
3.5 缓冲盐溶液:分别准确称取3.4g磷酸氢二钾(3.1.1)和0.4325g辛烷磺酸钠(3.1.2),用水溶解并定容至1L,摇匀,用磷酸(3.1.4)调至pH=2.5,经微孔滤膜(3.6)过滤,待用。
3.6 微孔滤膜:0.45μm,水相。
4 仪器和设备
4.1 高效液相色谱仪:配有紫外(UV)检测器或二极管阵列(DAD)检测器。
4.2 分析天平:感量分别为0.01mg、0.0001g和0.001g。
4.3 超声波提取器:功率250W,频率33kHz。
5 分析步骤
5.1 试样制备
5.1.1 试样提取
5.1.1.1 固体试样
准确称取粉碎并混合均匀的试样0.1g~2g(准确至0.0001g,含待测组分约5mg~50mg),于50mL容量瓶中,加入盐酸溶液(3.4)约35mL,超声提取10min,放至室温,用盐酸溶液(3.4)稀释至刻度,摇匀,过滤,弃初滤液,收集续滤液,再经微孔滤膜(3.6)过滤,续滤液进液相色谱仪分析。
5.1.1.2 软胶囊试样
取软胶囊剪开,挤出内容物并混匀,准确称取2g(准确至0.0001g),准确加入等量硅藻土(3.1.5),研至分散均匀,准确称取其中部分(准确至0.0001g,含待测组分约5mg~50mg),转移至250mL具塞三角瓶中,吸取盐酸溶液(3.4)50.0mL,并入三角瓶中,称重(准确至0.001g),加塞超声提取10min,放至室温,用盐酸溶液(3.4)补足重量,摇匀,过滤,弃初滤液,收集续滤液,再经微孔滤膜(3.6)过滤,续滤液进液相色谱仪分析。
5.1.1.3 液体试样
准确吸取混匀后的试样1.0mL~5.0mL(含待测组分约5mg~50mg),于50mL容量瓶中,加入盐酸溶液(3.4)约35mL,超声提取10min,放至室温,用盐酸溶液(3.4)稀释至刻度,摇匀,过滤,弃初滤液,收集续滤液,再经微孔滤膜(3.6)过滤,续滤液进液相色谱仪分析。
5.1.2 试样溶液稀释
必要时,根据试样溶液中左旋肉碱含量,用盐酸溶液(3.4)进行适当的稀释(稀释倍数F),使待测溶液中左旋肉碱的浓度在0.10mg/mL~1.00mg/mL范围内。
5.2 仪器参考条件
5.2.1 色谱柱:C18柱: 250mm×4.6mm,5μm或同等性能的色谱柱。
5.2.2 流动相:缓冲盐溶液(3.5)+乙腈(3.1.6),(90+10,v/v)。
5.2.3 流速:0.8mL/min。
5.2.4 检测波长:210nm。
5.2.5 进样量:20μL。
5.3 标准曲线的制作
将左旋肉碱标准系列工作液(3.3.2)分别按液相色谱参考条件(5.2)进行测定,得到相应的左旋肉碱标准溶液的色谱峰面积。以标准工作液的浓度为横坐标,以峰面积为纵坐标,绘制标准曲线。
5.4 待测溶液的测定
将待测溶液(5.1)按液相色谱参考条件(5.2)进行测定,得到相应的待测溶液左旋肉碱的色谱峰面积,根据标准曲线得到待测溶液中左旋肉碱的浓度,平行测定次数不少于两次。
左旋肉碱的标准液相色谱图参见附录A的图A.1。
6 结果计算
试样中左旋肉碱含量按下式计算:
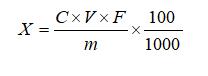
式中:
X—试样中左旋肉碱的含量,固体和软胶囊试样的单位为克每百克(g/100g),液体试样的单位为克每百毫升(g/100mL);
C—根据标准曲线计算待测溶液中左旋肉碱的浓度,单位为毫克每毫升(mg/mL);
V—试样提取时的定容体积,单位为毫升(mL);
m—试样称取的质量,单位为克(g);或液体试样吸取的体积,单位为毫升(mL);
F—稀释倍数;
100—单位转换;
1000—单位转换。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10%。

