医疗器械的生命周期涉及多个阶段,其中包括医疗器械的设计研发、原材料采购、生产及检验、临床试验、产品注册、上市后临床使用、经营与销售、以及最终停用和废弃处置等,可吸收医疗器械也不例外,大致可如下图所示:
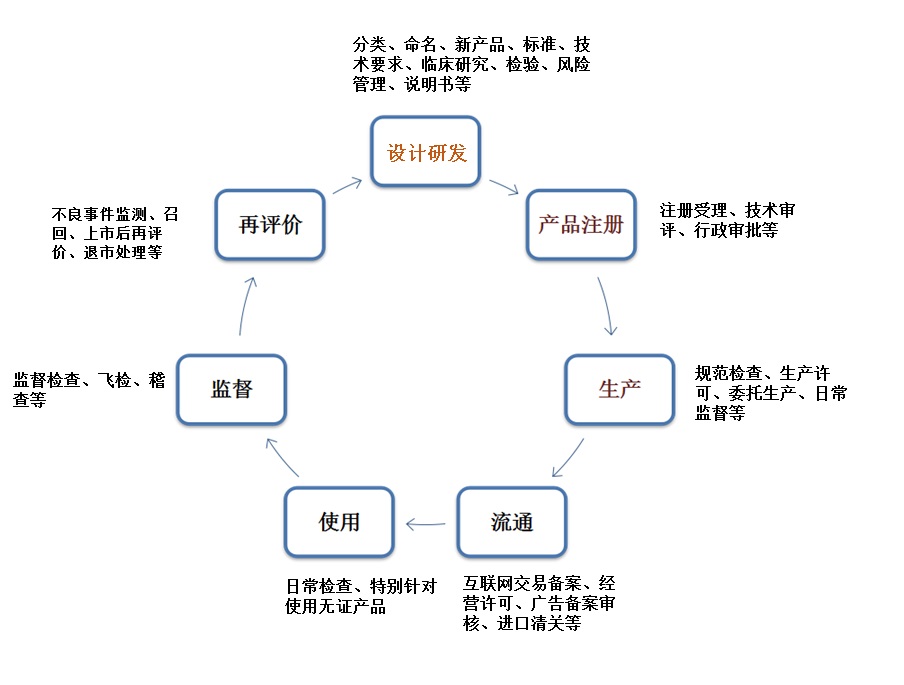
因此,关于可吸收医疗器械的监管可从这些阶段开展进行,针对这些不同阶段,CFDA也出台了相应的法规。具体详见下表:
|
阶段 |
法规 / 标准名称 |
实施日期 |
|
设计研发 |
YY/T 0316-2016 《医疗器械 风险管理对医疗器械的应用》 |
2017-01-01 |
|
《医疗器械分类规则》 |
2016-01-01 |
|
|
《医疗器械通用名称命名规则》 |
2016-04-01 |
|
|
《医疗器械说明书和标签管理规定》 |
2014-10-01 |
|
|
《医疗器械注册管理办法》 |
2014-10-01 |
|
|
生产和检验 |
《医疗器械生产监督管理办法》 |
2014-10-01 |
|
《医疗器械生产企业供应商审核指南》 |
2015-01-19 |
|
|
《医疗器械生产质量管理规范》 |
2014-12-29 |
|
|
《医疗器械生产企业质量控制与成品放行指南》 |
2016-12-30 |
|
|
《医疗器械生产质量管理规范 —— 无菌医疗器械现场检查指导原则》 |
2015-09-25 |
|
|
《医疗器械生产质量管理规范 —— 植入性医疗器械现场检查指导原则》 |
2015-09-25 |
|
|
YY/T 0287-2017 《医疗器械 质量管理体系 用于法规的要求》 |
2017-05-01 |
|
|
临床试验和 临床使用(上市后) |
《医疗器械临床试验质量管理规范》 |
2016-06-01 |
|
《医疗器械不良事件监测和再评价管理办法(试行)》 |
2008-12-29 |
|
|
《医疗器械不良事件监测工作指南(试行)》 |
2011-09-16 |
|
|
流通使用、监督抽查 |
《医疗器械经营监督管理办法》 |
2014-10-01 |
|
《医疗器械经营质量管理规范》 |
2014-12-12 |
|
|
《医疗器械使用质量监督管理办法》 |
2016-02-01 |
|
|
《医疗器械经营质量管理规范现场检查指导原则》 |
2015-10-15 |
|
|
《医疗器械召回管理办法》 |
2017-05-01 |
|
|
《医疗器械广告审查办法》 |
2009-05-20 |
|
|
《药品医疗器械飞行检查办法》 |
2015-09-01 |
|
|
《医疗器械网络销售监督管理办法》 |
2018-03-01 |
