1. 产品概述
1.1 产品名称
一次性 使用手术衣
1.2 结构组成
通常为基材和阻水层组成的手术室服装。基材一般由非织造布或纺织布制造,阻水层为阻水性的材料。非无菌提供可重复使用,由前身、后身、袖子、系带等组成。
产品图示举例:
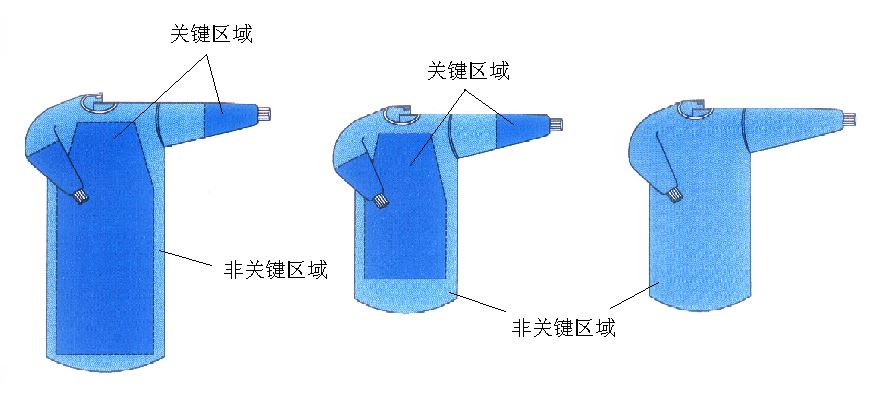
1. 3 预期用途
用于穿在手术医生和擦拭护士身上,起到防止医生身体上的皮屑弥散到开放的手术创面和手术病人的体液向医务人员传播,起到双向生物防护的作用。
1. 4 适用人群
医疗机构手术室医务人员。
1. 5 预期使用环境
医疗机构手术室
2. 分类信息
一次性使用手术衣分类编码为 14-13-05 ,按照第 II 类医疗器械管理,其分类信息如下表:
表 1 分类信息
|
子目录 |
一级 |
二级 |
产品描述 |
预期用途 |
品名举例 |
类别 |
|
14 注输、护理和防护器械
|
13 手术室感染控制用品 |
05 手术室用衣帽 |
通常为基材和阻水层组成的手术室服装。基材一般由非织造布或纺织布制造,阻水层为阻水性的材料。手术衣分为无菌提供一次性使用和非无菌提供可重复使用两种供应形式。手术衣按关键区域的屏障能力分为标准型和高性能型两种。手术帽为无菌提供,一次性使用。 |
用于穿在手术医生和擦拭护士身上,起到防止医生身体上的皮屑弥散到开放的手术创面和手术病人的体液向医务人员传播,起到双向生物防护的作用。 |
手术服、手术衣、外科手术衣、一次性使用无菌手术衣、非织造布手术衣、一次性无菌手术衣、一次性使用无菌手术服、一次性使用手术帽、一次性使用无菌帽 |
Ⅱ |
3. 注册单元
3.1 注册单元划分
按照医疗器械注册管理办法第二十七条要求, “医疗器械产品的注册单元原则上以技术结构、性能指标和预期用途为划分依据” 。
根据以上原则,高性能和标准性能的手术衣可以作为一个注册单元。
3.2 同一注册单元中典型产品的确定
( 1 )同一注册单元中典型产品是指能够代表本注册单元内其他产品安全性和有效性的产品,其功能最齐全,结构最复杂,风险最高。
( 2 )典型产品的确定可以通过比较同一注册单元内所有产品的技术结构、性能指标和预期用途等相应资料,说明能够代表本注册单元内其他产品的安全性和有效性。
( 3 )举例:高性能手术衣与标准性能手术衣相比,高性能手术衣性能指标要求更高。所以高性能手术衣和标准性能手术衣作为一个注册单元时,高性能手术衣应作为这个注册单元中的典型产品。
4. 临床试验 要求
一次性使用手术衣已经 列入免临床目录 ,免临床描述见下表:
表 2 免临床目录信息
|
分类编码 |
产品名称 |
产品描述 |
类别 |
|
14-13-05 |
一次性使用手术衣帽 |
一次性使用手术衣帽一般由具有一定防护特性的无纺布或覆膜无纺布复合材料制成;其中手术衣可由衣领、衣身、衣袖组成,也可由上衣、裤子组成,袖口、脚踝口为弹性收口,腰部收口可采用弹性收口、拉绳收口或搭扣;前襟、肘部等可设计成加强防护,以无菌形式提供,供手术人员穿着,降低感染源向病人手术创面传播以防止术后创面感染;具有阻止液体透过的手术衣,也可减小血液或体液中携带的感染源向手术人员传播的风险。产品性能指标采用下列参考标准中的适用部分,如: YY/T 0506 病人、医护人员和器械用手术单、手术衣和洁净服。 |
Ⅱ |
本产品设计定型、工艺成熟,临床应用多年,不改变常规用途,且无严重不良事件记录,通过非临床评价、注册检验及质量体系考核能够保证产品的安全性、有效性,故原则上不要求临床试验。
5. 技术要求
1.关键区域的划分
手术衣的前胸和袖部至少应有关键区域,如图 2所示的A区域和B区域。
手术衣前胸部关键区域上边缘离领口的距离不大于 10cm,关键区域的长度不少于70cm。关键区域的宽度应不小于45cm。
手术衣袖部关键区域至少为从腕关节(不包括袖口)到肘关节的环臂区域。
注:有些特殊手术,如骨科手术可能需要全袖均为关键区域。
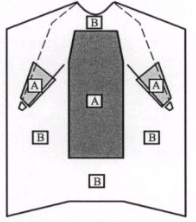
图 2 手术衣关键区域与非关键区域图示
( A 为关键区域, B 为非关键区域)
2.性能
手术衣关键区域包括关键区域内部结合处应符合 YY/T 0506.2-2016中表1规定的相应级别的关键区域的要求。
手术衣关键区域与非关键区域的结合处(若有)应符合 YY/T 0506.2-2016中表1规定的非关键区域的要求。
手术衣非关键区域包括非关键区域内部结合处(若有)应符合 YY/T 0506.2 -2016中表1规定的非关键区域的要求。
注 1:结合处的性能要求不适用于袖口的结合处和领口的锁边处。
注 2:肩部、腋部结合处不要求抗渗水性和阻干态微生物穿透。
3.规格
手术衣的横向尺寸应能将适用体形的医生除头部以下的周身全部覆盖,以起到组织医生皮屑向手术区域弥撒的作用。制造商应给出手术衣尺寸的图示和规格,以供使用者选择。
常用手术衣的规格示例:
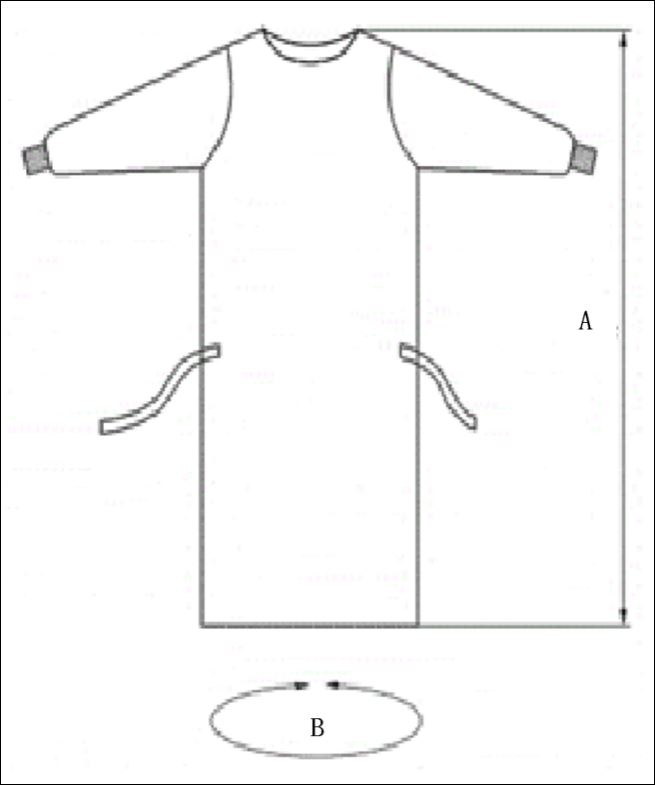
图 3 手术衣型式和规格示例图(A:衣长;B:展开衣宽)
表 3 手术衣规格尺寸 单位:厘米
|
规格 |
A(衣长) |
B(展开衣宽) |
|
S |
115 |
140 |
|
M |
120 |
150 |
|
L |
130 |
160 |
|
XL |
140 |
170 |
|
XXL |
150 |
175 |
|
XXXL |
170 |
180 |
|
偏差 |
±2 |
±2 |
4.透气性
若制造商声称产品具有高透气性,按照 YY/T 0506.2-2016中B.2规定的方法进行试验,其非关键区域的透气性应不低于150 mm/s。
注:高透气性手术衣适用于手术时间较长、医护人员对手术衣舒适性要求高的手术。
5.折叠
制造商应对手术衣的折叠形式进行确认,以确保其以最小污染、便于无菌操作的方式穿到手术医生的身上。
6.系带连接牢固性
手术衣颈部及腰部的系带应能承受 10N的轴向静拉力,持续1min无断裂或脱落现象。
7.灭菌要求
7.1无菌保证
一次性使用手术衣应无菌供应,应符合 YY/T 0615.1的要求。
7.2环氧乙烷残留量
一次性使用手术衣若采用环氧乙烷灭菌,按照 GB/T 16886.7规定的方法或等效方法试验时,环氧乙烷残留量应不大于 5 μg/g。
6. 主要 参考技术标准或规范
|
主要参考技术 标准 |
GB 18278.1-2015 医疗保健产品灭菌 湿热 第 1 部分:医疗器械灭菌过程的开发、确认和常规控制要求 GB 18279.1-2015 医疗保健产品灭菌 环氧乙烷 第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求 GB 18280 医疗保健产品灭菌 辐射 GB/T 16886.1-2011 医疗器械生物学评价 第1部分:风险管理过程中的评价与试验 GB/T 16886.7-2015 医疗器械生物学评价 第 7 部分:环氧乙烷灭菌残留量 GB/T 16886.10-2017 医疗器械生物学评价 第 10 部分:刺激与皮肤致敏试验 GB/T 19633 最终灭菌医疗器械包装 GB/T 14233.1-2008 医用输血、输液、注射器具检测方法 第 1 部分:化学分析方法 GB/T 14233.2-2005 医用输血、输液、注射器具检测方法 第 2 部分:生物试验方法 YY/T 0313-2014 医用高分子产品 包装和制造商提供信息的要求 YY/T 0287-2017 医疗器械 质量管理体系用于法规的要求 YY/T 0466.1-2016 医疗器械用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求 YY/T 0615.1-2007 标示“无菌”医疗器械的要求 第 1 部分:最终灭菌医疗器械的要求 YY/T 0316-2016 医疗器械 风险管理对医疗器械的应用 YY /T 0506.1 病人、医护人员和器械用手术单、手术衣和洁净服第 1 部分 : 制造厂、处理厂和产品的通用要求 YY /T 0506.2 病人、医护人员和器械用手术单、手术衣和洁净服第 2 部分 : 性能要求和性能水平 YY /T 0506.4 病人、医护人员和器械用手术单、手术衣和洁净服第 4 部分 : 干态落絮试验方法 YY /T 0506.5 病人、医护人员和器械用手术单、手术衣和洁净服第 5 部分 : 阻干态微生物穿透试验方法 YY /T 0506.6 病人、医护人员和器械用手术单、手术衣和洁净服第 6 部分 : 阻湿态微生物穿透试验方法 YY/T 0506.7 病人、医护人员和器 械用手术单、手术衣和洁净服 第7部分:洁净度-微生物试验方法 YY/T 0506.8 病人、医护人员和器械用手术单、手术衣和洁净服 第 8 部分:产品专用要求 中华人民共和国药典 |
|
指导原则 |
一次性使用手术衣产品注册技术审查指导原则 (食药监办械函 [2011]187 号) |
7. 手术衣主要 检测机构
山东省医疗器械产品质量检验中心( YY/T 0506.8 标准归口单位)
广东省医疗器械质量监督检验所
北京市医疗器械检测所
8. 一次性使用手术衣 产品的主要风险
一次性使用手术衣产品的风险分析报告应符合 YY/T 0316-2016 《医疗器械 风险管理对医疗器械的应用》的有关要求。以下依据 YY/T 0316的附录D从三个方面列举了一次性使用手术衣产品的危害因素。
产品主要危害
|
危害 类型 |
可能产生的危害 |
形成因素 |
控制措施 |
|
生物学危害 |
生物污染 |
产品没有灭菌或灭菌没有达到标准 |
严格控制灭菌工艺 |
|
环境污染 |
生产环境污染产品,如包装破损、外来的纤维、粉尘、细菌、其它杂质等 |
严格控制生产环境及包装工艺 |
|
|
生物相容性 |
生产引入了外来有害物质没有被有效去除;环氧乙烷残留量超标 |
原材料入厂检验; 严格控制灭菌工艺 |
|
|
与产品使用相关的危害 |
不适当的标签 |
外部标记不全面、标记不正确或不能够清楚易认 |
标记印刷清晰正确;标记内容按相关要求标记全面。 |
|
说明书上的注意事项不全 |
如缺少详细的使用方法、缺少必要的警告说明; 使用前未检查产品 灭菌或包装状态; 产品等级标示不清 |
规范说明书; 说明书上提示 |
|
|
由不熟练或未经训练的人员使用 |
使用者未经培训或培训不足,不能正确使用产品; |
使用前培训 |
|
|
对一次性使用产品的很可能再次使用的危害性警告不适当 |
说明书中未包含只限一次性使用 |
规范说明书 |
|
|
功能失效引起的危害 |
不适当的预期用途表述 |
说明书中未能清楚表明产品用途 |
规范说明书 |
|
不适当的产品包装 |
生产、运输、搬运和储存过程中导致包装破损; 包装封口不严密; 包装材料选择不适当 |
规范包装 |
|
|
失去产品的完整性 |
产品各构件之间缝制或粘合达不到隔离要求; |
严格控制生产工艺、产品检验 |
