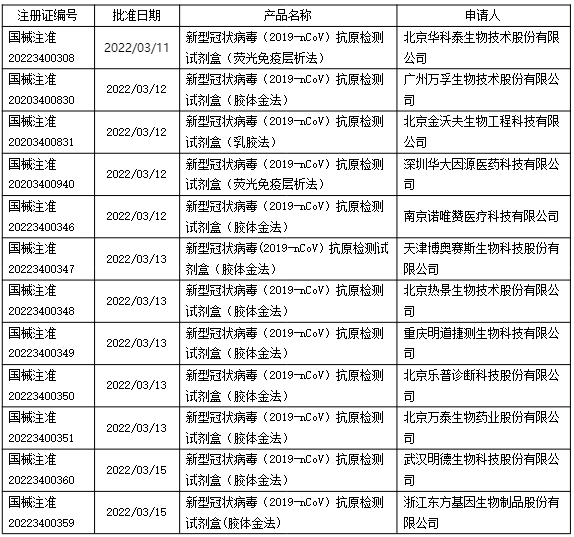
近期,疫情再次在国内蔓延,为了缓解新冠病毒检测压力,优化新冠病毒检测策略,3月11日,国家卫健委发布《新冠病毒抗原检测应用方案(试行)》通知,首次明确了新冠病毒抗原自测的相关政策。目前国家局已陆续批准了12个新型冠状病毒(2019-nCoV)抗原自测试剂盒,包括注册变更(增加自测应用)和应急审批注册。具体产品批准信息如下:
据了解,目前计划申报新型冠状病毒抗原检测试剂盒的企业可以申请应急或者优先审批通道,与常规注册流程相比,在审评时限上有了明显缩短,同时还有专人指导。
一、应急审批通道注册申报流程:
目前已经有上市的新型冠状病毒抗原检测试剂盒,但如果产品供应不能满足突发公共卫生事件应急处理需要的话,还是有希望走应急审评通道的,但企业在申请应急申请之前应提前跟国家药品监督管理局确认。
1.申请企业汇总拟申报产品的研制信息,告知所在地省、自治区、直辖市药品监督管理局 。省药监局会对拟申报产品的情况进行评估,并进行早期介入,及时指导注册申请人开展相关申报工作。
2.申请企业编制《医疗器械应急审批申请表》、产品研究综述资料及相关说明,提交到国家药监局。 国家局会对拟申报产品是否符合应急审批的要求及研发成熟度、生产能力等进行评估,确认产品是否通过应急审批。最终结果会通知申请企业、相应技术机构和省、自治区、直辖市药品监督管理局。
3.申请企业应在确认应急审批之日起90日内,按照注册要求完成注册申报资料准备,并获得注册申请受理。 注册要求包括3个方面:(1)国家局对拟申报产品提出的注册资料要求;(2)新型冠状病毒抗原检测试剂注册技术审评要点(试行);(3)关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告(2021年第122号)。 企业需要注意的是: 企业提交注册申报资料后,国家药监局会进行立卷审查,立卷审查通过后,才会受理。所以,并不是企业提交注册申报资料就会被受理,如果不符合立卷审查要求,会被受理发补。如果因为受理发补,企业补充资料的时间过久,导致未在90日内获得注册申请受理,国家局将不再按照应急审批办理。这种情况下,企业可以再去尝试走优先审批程序。
4.应急审批程序会加快注册进度,但不会减少注册环节。 企业提交注册申报资料后,进入技术审评和体系核查阶段。 体系核查时限: 对于应急审评产品,申请人所在地省、自治区、直辖市药品监督管理局会在接到国家药监局通知后2日内组织开展质量管理体系核查,并及时出具质量管理体系核查报告,提交国家药监局医疗器械技术审评中心。 技术审评时限: 国家药监局会在10日内完成技术审评;技术审评结束后,在3日内完成行政审批。
二、优先审批通道注册申报流程:
如果应急审批通道走不通的话,可以尝试走优先审批通道。
1.申请企业需要先将产品研发情况告知相应的省、自治区、直辖市药品监督管理局。 省、自治区、直辖市药品监督管理局会对相关医疗器械的研制情况进行评估,初审之后,省、自治区、直辖市药品监督管理局再将拟申报产品信息报到国家局。
2.申请企业按照注册要求完成注册资料准备。 注册要求包括4个方面:(1)国家局对拟申报产品提出的注册资料要求;(2)新型冠状病毒抗原检测试剂注册技术审评要点(试行);(3)关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告(2021年第122号);(4)医疗器械优先审批申报资料编写指南(试行)(国家局2017年第28号通告附件)。
3.申请企业在向国家局提交注册申请时,同步提交优先审批申请 。与应急审批不同的是,应急审批申请是在向国家局提交注册申请前进行,优先审批申请是在向国家局提交注册申请的同时进行的。
4.优先审批程序会缩短注册审评时间,但不会减少注册环节。 企业提交注册申报资料后,国家药监局会先进行立卷审查。立卷审查通过,正式受理后,器审中心会对优先审批申请进行审核,符合优先审批情形的,予以优先审批。 技术审评时限: 国家局会按照接收时间单独排序,优先进行技术审评。 体系核查时限: 省级食品药品监督管理部门优先安排医疗器械注册质量管理体系核查。
企业想要走绿色通道进行申报的话,现在就必须要加快产品研发进度,尽快进行产品注册检验、临床评价及向所在地省、自治区、直辖市药品监督管理局进行前期沟通。对于现在想要申报新型冠状病毒抗原检测试剂盒的企业,应该做哪些准备工作及有哪些注意事项,请见《申报新冠抗原检测试剂盒企业应对策略》。
UC的服务
