近日,国家药品监督管理局发布了 2020年修订版的需进行临床试验审批的第III类医疗器械目录(以下简称“临床审批目录”),列入临床审批目录的医疗器械产品,在中国开展临床试验之前需要先通过临床试验审批。本文整理总结了临床试验审批流程及申报要求,供医疗器械企业参考学习。
医疗器械临床试验技术咨询联系方式: 0571-87206527 或010-83123902,md@hfoushi.com.
1. 哪些医疗器械将纳入临床试验审批目录?
与境内外已上市产品相比,采用全新设计、材料或机理适用于全新适用范围,且对人体具有较高风险的医疗器械将纳入临床试验审批目录。临床试验审批目录动态管理,由国家药品监督管理局制定、调整并公布,最新实施的临床试验审批目录于 2020年9月14日发布并实施,目录见文末附件。
2. 临床试验审批流程
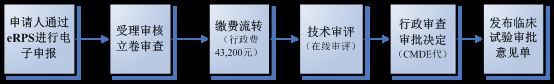
医疗器械临床试验审批执行 默示许可制 ,既自临床试验审批申请受理并缴费之日起 60个工作日 内,申请人在预留联系方式、邮寄地址有效的前提下,未收到器审中心意见(包括专家咨询会议通知和补充资料通知)的,可以开展临床试验。
3. 临床试验审批审评意见有哪些?
- 专家咨询
- 补正资料
- 联合审评
- 准予开展临床试验
- 不予批准开展临床试验
4. 临床试验审批申报资料要求
|
序号 |
资料要求 |
|
|
1 |
申请表 |
|
|
2 |
证明性文件 |
境内申请人:企业营业执照及组织机构代码证;境外企业:原产国批准的产品上市销售证明及中国境内代理人委托书及代理人资质证明 |
|
3 |
与评价试验用医疗器械安全性和有效性相关的已发表文献及评论性综述。 |
|
|
4 |
综述资料 |
应当包括试验用医疗器械的设计原理、工作原理、产品特征、结构组成及图示、制造材料、包装材料、型号规格及其划分依据、主要生产工艺、交付状态、作用机理、适用范围等内容 |
|
5 |
国内外同类产品研发、上市及临床应用情况及试验用医疗器械与国内外已上市同类产品在工作原理、结构组成、制造材料、技术参数及适用范围等方面的异同比较资料。 |
|
|
6 |
风险分析报告 |
|
|
7 |
产品技术要求 |
|
|
8 |
检测报告 |
医疗器械检验机构出具的检验报告和预评价意见。 |
|
9 |
临床试验方案及方案合理性的分析资料 |
临床试验方案应当符合国家食品药品监督管理总局发布的《医疗器械临床试验质量管理规范》相关要求,并提交证明临床试验方案科学合理性的分析资料。 |
|
10 |
伦理委员会同意临床试验开展的书面意见 |
在多中心开展临床试验的,应当提交牵头单位伦理委员会同意临床试验开展的书面意见;在非多中心开展临床试验的,应当提交全部临床试验机构的伦理委员会同意临床试验开展的书面意见。 |
|
11 |
包装标签 |
|
|
12 |
说明书 |
|
|
13 |
不良事件信息 |
|
|
14 |
符合性声明 |
申请人声明本产品符合《医疗器械注册管理办法》和相关法规的要求及所提交资料的真实性。 |
5. 医疗器械临床试验审批意见单主要内容
- 受理号 ()
- 申请人名称
- 申请人住所
- 试验用医疗器械名称
- 试验用医疗器械型号、规格
- 试验用医疗器械结构及组成
- 审批意见
- 备注 (eRPS系统通知申请人)
附件:需进行临床试验审批的第三类医疗器械目录( 2020年修订版)
|
序号 |
产品类别 |
分类编码 |
产品描述 |
|
1 |
植入式心脏节律管理设备 |
12 |
植入式心脏起搏器:通常由植入式脉冲发生器和扭矩扳手组成。通过起搏电极将电脉冲施加在患者心脏的特定部位。用于治疗慢性心率失常。再同步治疗起搏器还可用于心力衰竭治疗。 植入式心脏除颤器:通常由植入式脉冲发生器和扭矩扳手组成。通过检测室性心动过速和颤动,通过电极向心脏施加心律转复/除颤脉冲对其进行纠正。用于治疗快速室性心律失常。再同步治疗除颤器还可用于心力 衰竭治疗。 |
|
2 |
植入式心室辅助系统 |
12 |
通常由植入式泵体、电源部分、血管连接和控制器组成。用于为进展期难治性左心衰患者血液循环提供机械支持,用于心脏移植前或恢复心脏功能的过渡治疗和/或长期治疗。供具备心脏移植条件与术后综合护理能力的医疗机构使用,医务人员、院外护理人员以及患者须通过相应培训。抗凝治疗不耐受患者禁用。 |
|
3 |
植入式药物输注设备 |
12 |
通常由药物灌注泵、再灌注组件和导管入口组件组成。该产品与鞘内导管配合使用,进行长期药物的输入。 |
|
4 |
人工心脏瓣膜和血管内支架 |
13 |
人工心脏瓣膜或瓣膜修复器械:一般采用高分子材料、动物组织、金属材料、无机非金属材料制成,可含或不含表面改性物质。用于替代或修复天然心脏瓣膜。 血管内支架:支架一般采用金属(包括可吸收金属材料)或高分子材料(包括可吸收高分子材料)制成,其结构一般呈网架状。支架可含或不含表面改性物质,如涂层。可含有药物成分。如用于治疗动脉粥样硬化、以及各种狭窄性、阻塞性或闭塞性等血管病变。 |
|
5 |
含活细胞的组织工程医疗产品 |
13/16/17 |
以医疗器械作用为主的含活细胞的无源植入性组织工程医疗产品。 |
|
6 |
可吸收四肢长骨内固定植入器械 |
13 |
采用可吸收高分子材料或可吸收金属材料制成,适用于四肢长骨骨折内固定。 |
