自2017年保健食品备案制度实施以来,每一年瑞旭集团均会盘点我国保健食品备案产品情况,并发布数据分析文章。而根据特殊食品信息查询平台、国家市场监督管理总局食品审评中心和各省、市、自治区市场监督管理局的公开信息显示,国产产品的备案量通常远高于进口产品(见图1)。
于是,许多境外保健食品申请人看到数据对比后便产生怀疑:备案量相差如此巨大,进口保健食品备案的申报难度是否比国产备案大很多?为了帮助企业解决上述困惑,瑞旭集团基于多年的备案申报经验,详细对比国产备案与进口备案的区别,重点介绍进口备案过程的难点和注意事项。
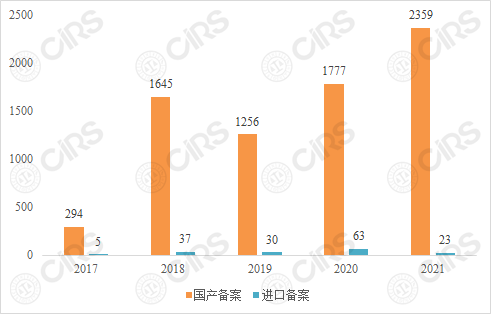
图1:2017-2021年保健食品备案数量(国产VS进口)
国产备案与进口备案的基本区别
|
项目 |
国产备案 |
进口备案 |
|
主管部门 |
各省、市、自治区市场监督管理局 |
国家市场监督管理总局食品审评中心 |
|
申请人资质 |
保健食品生产企业 |
上市保健食品的境外生产厂商 (指产品符合所在国(地区)上市要求的法人或者其他组织) |
|
备案范围 |
使用的原料已经列入保健食品原料目录的保健食品。目前包括: 1.补充维生素、矿物质等营养物质的营养素补充剂; 2.辅酶Q10、褪黑素、螺旋藻、破壁灵芝孢子粉、鱼油五种原料制成的单方产品。 |
首次进口的属于补充维生素、矿物质等营养物质的保健食品。 |
首先,两者的主管机构不同。 在数据统计中可以发现,备案产品的信息公开情况在各地是不同的。总体而言,多数省局的公开速度较为及时。而当前,食品审评中心作为进口已备案产品的主要发布窗口,其信息发布速率较为滞后,因此官方发布的产品量一定程度上低于进口保健食品的实际备案量。其次,食品审评中心面对全球境外企业申报的产品,产品数量大,整体进口产品的审评技术反馈周期要长于国产产品。
第二,备案主体不同。 国产产品要求其备案主体必须是保健食品生产企业。而对于进口产品来说,并未有这一限制。进口产品备案主体可以是境外保健食品生产企业,也可以是非生产企业,如产品所有人(委托方)。
第三,国产备案的范围比进口产品更广。 这是受限于《食品安全法》第七十六条的相关规定。预期在《食品安全法》修订前,除营养素补充剂外,进口企业使用辅酶Q10等其他纳入保健食品原料目录的功能性原料生产的产品仍然需要申请注册。但值得庆幸的是,根据2021年12月20日发布的《保健食品原料目录营养补充剂(2022年版)(征求意见稿)》,DHA拟将成为新的营养素。由于该物质的功能“补充n-3多不饱和脂肪酸”属于补充营养物质的范围,瑞旭集团认为进口企业日后也可申报DHA产品的备案。
进口保健食品备案账号申请
作为首次申报企业,不论是国产还是进口,均需要通过“保健食品备案管理信息系统”向主管机构申请一个备案账号。获得备案账号后,企业通过登陆系统在线提交产品备案申请。因此,为了缩短备案周期,瑞旭集团建议企业备案账号的申请和保健食品备案的申请同时准备,一旦获取备案账号,即刻线上提交产品备案申请是最为快速的操作。
与国产企业不同之处在于,境外企业在申请账号时需提交以下三份证明文件:
- 产品生产国(地区)政府主管部门或法律服务机构出具的备案人为上市保健食品境外生产厂商的资质证明文件
- 联系人授权委托书
- 备案人法人代表的护照扫描件
这三个文件看似简单,实则也有许多细节需要注意。比如:
- 备案人资质证明文件和联系人授权书必须严格按照备案法规要求开具,经所在国(地区)公证机构公证、中国大使馆确认,并在中国完成中文译本的公证。
- 法人护照扫描件必须要清晰完整,且是彩色的。
- 所有信息需完全保持前后一致。以申请人地址为例,若资质证明文件中的地址含有邮编,而系统填写时地址中未填写邮编,便是前后信息不一致。
- 此外,线上账号审核通过后,需将材料邮寄至食品审评中心受理大厅或携带至现场进行一致性确认后方能正式获得账号。
- ……
许多缺乏经验的境外企业在申请账号的过程中,常因文件开具单位错误、要点内容不全、信息前后不一致等诸多问题被反复退回,因而耗费了大量的人力和宝贵的时间。
进口备案申报需额外提交的资料
在申报资料方面,国产和进口产品在备案主体材料上的要求是基本一致的。但相比国产产品,进口产品在备案过程中需要额外提交以下材料:
进口保健食品备案额外需要准备的材料
- 备案人主体登记证明文件(产品生产国(地区)政府主管部门或者法律服务机构出具的备案人为上市保健食品境外生产厂商的资质证明文件);
- 备案产品上市销售一年以上证明文件(产品生产国(地区)政府主管部门或者法律服务机构出具的保健食品类似产品上市销售一年以上的证明文件,或者产品境外销售以及人群食用情况的安全性报告);
- 产品生产国(地区)或者国际组织与保健食品相关的技术法规或者标准原文,保证生产质量管理体系有效运行的自查报告,符合良好生产质量管理规范的证明文件;
- 产品生产国(地区)上市的包装、标签、说明书实样、中文译本及公证书;
- 由境外备案人常驻中国代表机构办理备案事务的,应当提交《外国企业常驻中国代表机构登记证》及其复印件。境外备案人委托境内的代理机构办理备案事项的,应当提交经过公证的委托书原件以及受委托的代理机构营业执照复印件。
于境外企业而言,上述资料中多份证明文件的出具经常成为影响其周期的因素之一。找谁出具?文件内容需包括哪些要点?非英语国家用什么语言?出具后需进行哪些后续操作?……诸多细节问题都需要被一一关注,否则一旦食品审评中心对这些文件内容提出意见,重新准备一份合格的证明文件又需要耗费较长一段时间。
除此之外,随着食品审评中心逐步加强资料审查力度,一些基本资料的要求也被不断细化强调。例如:部分资料除中文资料外,还需要提交一份相应的外文资料附后。参考保健食品注册要求,产品功效成分的检测标准中若有多个检测方法的,产品技术要求中需写明采用的第几法等。
小结:进口保健食品备案的难点
从备案数据来看,国产与进口产品备案量相差巨大,有产品申报基数的差别,也有审评周期和公布速率的影响。而从申报要求来说,同一款产品在申报流程、备案试验等方面,国产与进口并不存在本质差别。但境外企业需要了解到,进口保健食品备案账号的申请和产品的备案申请还是会面临以下几个难点:
★ 对法规的透彻理解
保健食品备案相关的法规较多,内容也较为丰富,只有对法规非常熟悉的技术人员才能做到全面理解,合理规划,尽可能的少走弯路。
★ 有丰富的实操经验
瑞旭集团在长期工作中发现,除了法规中的细节要求,有些不成文要求可能没法在法规中量化或说明,只有具有相关备案经验的技术人员,并经常和食品审评中心的老师沟通,才能了解到这些细节问题,精准把握尺度。
★ 对法规政策的实时跟踪
法规中大部分内容的要求是不会变化的,但是对于一些细节问题的要求,食品审评中心会根据他们的评估监测,不定期的细化对备案资料的要求。另外法规也有可能不断在更新,备案系统也会不定期做出一些调整。以瑞旭集团举例,食品事业部有专门的人员监测法规的变动并通知所有人,任何技术人员在处理新项目时,若发现评审的要求有变化,也会通知给部门所有人,以此来避免下个项目走弯路。
以上几个难点,进口保健食品企业若要攻克,需要花费不少精力和财力。因此绝大部分的进口备案类保健食品企业选择委托境内的代理机构办理备案事项。瑞旭集团可提供保健食品注册和保健食品备案服务,企业若有任何需要,欢迎随时联系UC。
网络研讨会(直播免费):保健食品注册/备案最新法规宣贯和实操技巧分享

瑞旭集团将于 2022年3月22-23日 举办保健食品系列网络研讨会。本 次研讨会共计4大话题,帮助您第一时间掌握保健食品领域的热点话题和最新法规变动,且采用3种语言(中、英、日),让您参会无忧!
- 话题一:我国保健食品最新法规宣贯
- 话题二:进口保健食品备案实操专场
- 话题三:保健食品注册申报要点与面临的挑战
- 话题四:保健食品标签标识最新要求和常见错误
戳 这里 了解会议详情和参会方式~
相关推荐:
- 2021年上半年保健食品注册类产品批件发布情况分析
- 保健食品常见问题与解答-备案篇(1):原辅料
- 备案稳定性实验如何执行?是否可以委托检测?保健食品常见问题与解答——备案篇(2):理化检验及质量标准
- 进口保健食品备案证明文件怎么出?保健食品常见问题与解答——备案篇(3):进口保健食品备案
- 备案保健食品信息如何填报?保健食品常见问题与解答——备案篇(4):其它
- 瑞旭再传捷报!17款进口保健食品备案产品发布,近半数由瑞旭申报成功!
UC的服务:
