什么是GRAS?
GRAS,是“Generally Recognized as Safe”(一般公认为安全)的缩写,是美国食品法规体系中非常重要的一个类别。与美国的新食品添加剂请愿相比,GRAS物质可豁免美国上市前审批,也就是说,通过GRAS后,企业便可合法在美国上市销售该物质。
GRAS的发展时间线
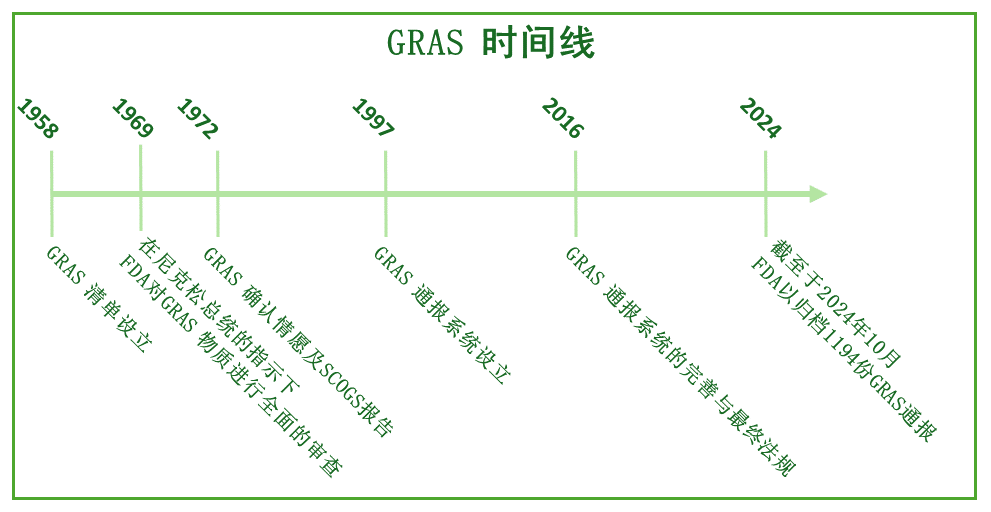
从上图可以看到,从1958年提出GRAS概念来,美国GRAS法规经历了多次重要的变迁,具体如下:
1958年:提出GRAS管理,制定GRAS物质清单
1958年《食品添加剂修正案》制定中,美国国会认识到许多食品物质不需要FDA的正式上市前审查来确保其安全性,主要原因是:
- 这些物质通过长期在食品中的使用历史已经证明了其安全性;
- 或者由于这些物质的性质、使用条件以及科学家普遍可获得的信息。
因此,根据1958年的修正案,如果某种物质对某种用途是GRAS,那么该用途可以在不经过FDA审查和批准的情况下上市。
同时, FDA澄清了大量在1958年之前的食品物质的监管状态,并在当年12月9日发布了GRAS物质清单。当前的清单显示在21 CFR第182、184和186部分。
1958年-1970年:意见信
虽然根据1958年修正案,如果某种物质在其预期使用条件下被认为是GRAS,那么可以在没有机构审查和批准的情况下用于该用途,然而许多制造商会选择向FDA请求意见信,获取FDA对其结论是否合理的意见。而FDA在评估后向该制造商提供对其产品非正式的意见信。该类建议书通常:【只提供给请求者,非公开】。
由于缺少约束力,这些意见信于1970年被撤销。
1970年-1980年左右:全面审查
当时的科学研究表明,甜蜜素盐,一种非营养性甜味剂,涉及对膀胱肿瘤的影响,随后FDA将该类甜味剂从GRAS清单中删除。1696年,在总统尼克松的指示下,FDA开始对GRAS清单上列出的物质进行全面审查。
通过成立【GRAS物质特别委员会(SCOGS)】,独立评估了这些物质并出具科学报告,帮助FDA重新评估每种物质的GRAS状态。
1970-1980左右,基于SCOGS的审查报告,FDA将所需认证的物质进行了评估。截至1982,SCOGS已经对400多种物质进行了审查并提出了意见。
1972年-1997年: “GRAS确认”程序
1972年,FDA建立了“GRAS确认”程序。对于行业而言,企业或个人可以选择向FDA提交“GRAS认可请愿书(GRAS Affirmation Petition)”来确认其物质的GRAS状态。 FDA根据标准审查该物质后,将“合格”物质列入“GRAS物质清单”(21 CFR 184和21 CFR 186)。
从下图可以看到,GRAS确认程序耗时很长,不利于企业的参与,许多请愿的审评时长超过72个月。
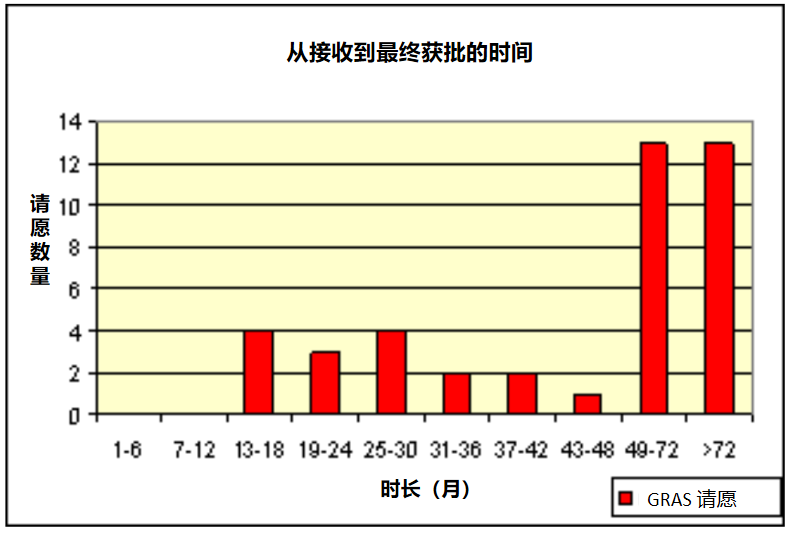
图片参考来源:FDA官网
1997年-至今:FDA启动“GRAS 通报”计划
1997年,FDA设立了自愿的“GRAS通报(GRAS Notification)”计划,也就UC现在所熟知的”FDA GRAS认证”,以取代GRAS确认情愿书。
- FDA允许任何人向FDA发送GRAS通报。
- FDA通过信函方式回应通知人。目前,通过FDA GRAS Notices数据库,可查询到1998年以来所有GRAS通报物质信息及FDA回函。
- 2016年,FDA发布了GRAS“最终规则(Final Rule)”,澄清更多法规问题。
在完成卷宗归档后,FDA需在6个月,特殊情况不超过9个月内做出回应。与此前的“GRAS确认”程序相比,时间被大大缩短。
UC的服务
-
美国GRAS认证咨询及培训
-
GRAS自我声明
-
FDA GRAS认证
